Som en tommelfingerregel faller pH i jorda med 0,05-0,1 enhet pr år, mest på sandjord, mindre på leirjord, mest når pH er høy, mindre når pH blir lavere. Det anbefales å ta ut jordanalyser hvert 5. år. De fleste kulturplantene våre trives best når pH er 6,0-6,5. En annen tommelfingerregel er at pH stiger med ca 0,1 enheter ved å kalke med 100 kg kalksteinsmjøl (karbonatkalk) pr daa.
Aluminium har skylda
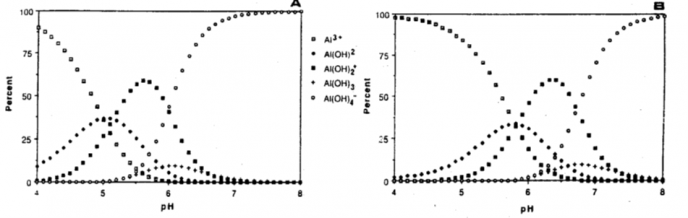
Sur jord eller lav pH betyr at det er et stort overskudd av H+-ioner i jorda. Hva er det så med H+-ionene som er så skadelig for plantene? Det skal egentlig ganske høy konsentrasjon av H+ til før plantene tar direkte skade av det. Det vil si at pH må være svært lav før H+-ionene i seg selv gjør skade. Problemet er at høy konsentrasjon av H+ fører til at aluminiumforbindelser fra jordpartiklene løses ut i jordvæska. Det er disse aluminiumforbindelsene som er skadelig for plantene.
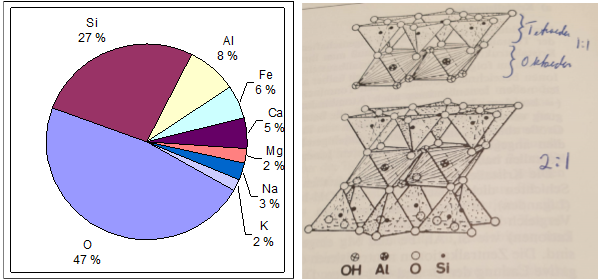
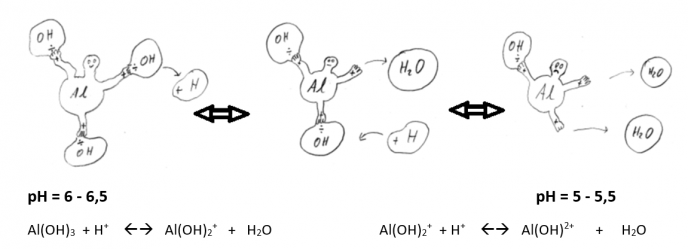
Det er utømmelige mengder med aluminium i mineraljord, siden aluminium sammen med silisium danner selve skjelettet i strukturen til leirpartiklene. Når det blir surt, løses ulike forbindelser med aluminium ut i jordvæska. De ulike aluminiumforbindelsene har ulik grad av mobilitet og giftighet overfor plantene. De enkleste forbindelsene består ev et aluminiumatom som med sine tre «armer» har knyttet til seg 0, 1, 2 eller 3 OH- -ioner. Vann kan spaltes opp til den basiske delen OH- og den sure delen H+. Når pH er 6,0 – 6,5 har ganske mange av aluminiumatomene (Al) knyttet til seg 3 OH- - ioner, og har således ingen «frie armer».
Aluminium binder seg til fosfat og organisk materiale
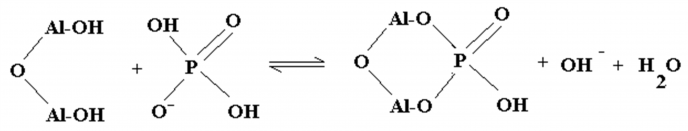
«Armene» til aluminium har positive ladninger, som gjerne vil gripe fatt i stoffer som har «ledige armer» med negative ladninger. Fosfat og organisk materiale har «ledige armer» med negative ladninger, og binder seg derfor lett til aluminium. I sur jord vil aluminiumets ledige armer gripe tak i fosfat og gjøre det mindre tilgjengelig for plantene. Når alumimiumets to ledige armer griper fatt i fosfatets to ledige armer, sier vi at aluminium danner kompleksbinding med fosrfor. Når begge stoffene hoder fast i hverandre med to armer, henger de svært godt sammen.
Hvorfor er aluminium skadelig?
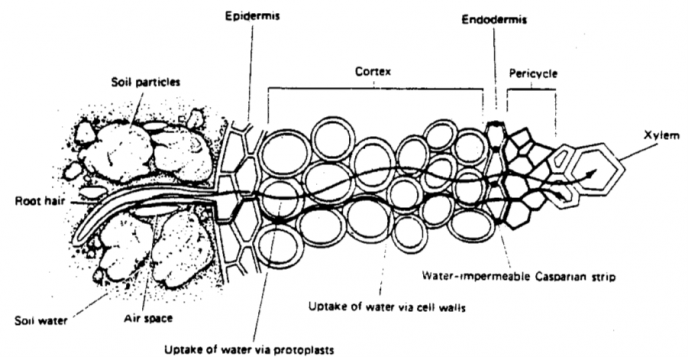
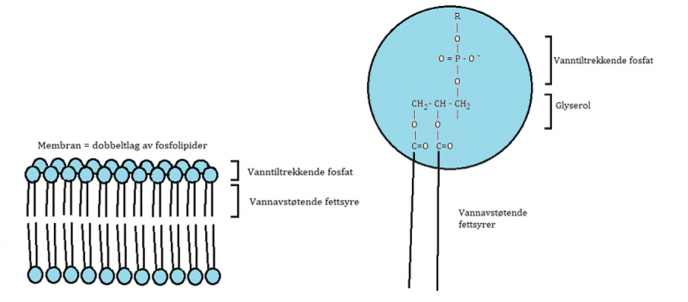
Rundt hver celle er det en membran, Det er også egne membraner rundt organellene inni cellene, rundt blant annet cellekjernen og rundt cellenes energisentre (mitokondrier). Vann og næring tas opp gjennom rothåra og transporteres mellom cellene og gjennom cellene inn i planta. Vannet og næringsstoffene kommer da i kontakt med mange membraner på vei inn i planta. Membranene holder ting på plass, samtidig som de slipper enkelte stoffer gjennom. Noen stoffer slipper lett gjennom membranene, men andre må ha hjelp av kjemiske hjelpestoffer (enzymer).
Ulike måter aluminium hindrer plantevekst
Ytterst på hver side av membranveggen er det tett i tett med negativt ladde fosfatarmer som hjelper til med transport av stoffer gjennom membranen. Når aluminium kommer i kontakt med ladningene på membranveggene, slipper de ikke så lett taket. Det fører til at membranenes evne til å slippe gjennom andre stoffer, blir hemmet. Dette gjelde både for membranen rundt cellene og membranene rundt organellene inni cellene.
Aluminium binder seg også til andre negative ladninger i cellene, og særlig de som involverer fosfat. Mye av energioverføringen i cellene dreier seg om små organiske stoffer som binder til seg eller slipper løs fosfat (ATP – ADP). Når aluminiumet blander seg inn i denne prosessen, hindres energikrevende prosesser i planta. Dette går utover celledeling, vekst og næringstransport.
Aluminium binder seg også til arvestoffet i cellene (DNA), og forstyrrer prosessene der cellene deler seg og arvestoffet kopieres. Dette fører til redusert celledeling og vekst i planterøttene.
Ved sur jord og høy aluminiumkonsentrasjon i jorda, vil også aluminiumkonsentrasjonen øke oppover i plantene, men det er først og fremst i røttene konsentrasjonen kan bli svært høy, og det er også på røttene at vi først ser skade. Men hele planta vil utvikle seg dårlig når prosessene i røttene ødelegges.
Hvordan overlever surjordsplanter?
De finnes planter som vokser godt på sur jord også, eksempelvis røsslyng, blåbær og furu. De håndterer fint pH på 3,8 – 4,5, uten å ta skade. Plantene har to viktige mekanismer til å beskytte seg mot skade av aluminium. Den ene går ut på å skille ut organiske syrer i rota, slik at aluminium binder seg til de organiske syrene. Dermed hindres aluminiumet i å komme inn i planta og gjøre skade.
Den andre mekanismen går ut på at plantene reagerer på økende aluminiumkonsentrasjoner ved å produsere stoffer som bindes sterkt til aluminium inne i planterota, slik at det ikke får mulighet til å binde seg til og hindre de livsnødvendige prosessene i planta. Plantenes evne til å beskytte seg er genetisk betinget og kan også variere mellom sorter innenfor samme art.
Hvorfor tåler plantene lavere pH når de vokser på myrjord?
På myrjord og på jord med høyt innhold av organisk materiale, kan plantene tåle vesentlig lavere pH enn hva de gjør på mineraljord. Det er to årsaker til dette. På rein myrjord finnes det ikke leirmineraler, eller innholdet av leirmineraler er svært lavt. Selv om det er rikelig med H+-ioner i slik jord, vil det bare i begrenset grad være leirpartikler som aluminium kan løses ut fra. Da vil det selvfølgelig også bli begrenset hvor mye aluminium som kommer i kontakt med planterøttene.
Den andre årsaken til at aluminium ikke får gjort like stor skade i jord med høyt innhold av organisk materiale, er at delvis omdannet organisk materiale inneholder mange armer med negative ladninger som aluminium binder seg til når det blir løst ut fra leirmineralene.
Det er viktig å øke jordas innhold av organisk materiale. I jord med lavt organisk innhold kan selv økning med 1-2% gi vesentlig bedre evne til å holde på og bytte ut vann og næring. Skal vi få nevneverdig effekt av organisk materiale med tanke på å redusere aluminiumets skade på planterøttene, må vi flere titalls prosent opp i organisk innhold i jorda. Dyrking av fangvekster og eng og tilføring av husdyrgjødsel og kompost, må derfor ikke bli noen sovepute i forhold til å kalke.